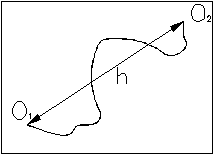
В качестве простейшей модели биополимера рассмотрим свободно-сочлененную
цепь. Будем считать, что цепь состоит из ряда прямолинейных сегментов,
каждый из которых включает определенное число отдельных звеньев. Внутри
каждого сегмента сохраняется абсолютная корреляция в ориентации звеньев.
При этом между сегментами эта корреляция полностью отсутствует.

Радиус-вектор
между концами цепи может быть представлен в виде суммы отдельных векторов
li,
характеризующих каждый сегмент. Число сегментов должно быть достаточно
большим (не меньше 80), чтобы можно было корректно использовать статистические
подходы.
и может
внутри него принимать любые значения. Вероятность того, что определенный
сегмент находится в определенном положении относительно другого сегмента,
может быть выражена через функцию распределения Wa вектора
расстояний между сегментами цепи. Функция Wa называется
функцией распределения величины a или плотностью вероятности нахождения
данного значения a, если произведение Wada равно
вероятности нахождения значения переменной a в интервале от a
до a+da:
.
В термодинамике строго доказывается, что для достаточно длинной свободно-сочлененной цепи, находящейся в термодинамическом равновесии с окружающей средой, функция распределения является гауссовой.
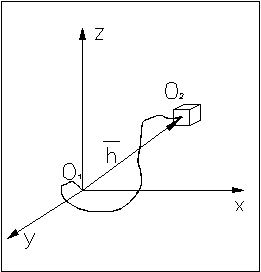
Для определенности введем систему координат, в начало которой поместим начало цепи.
,
,
.
Функции распределения координат x, y, z конца цепи являются гауссовыми.
Так как x, y,
z являются независимыми, то вероятность
попадания конца цепи в элемент объема
окрестности точки (x, y, z) равна произведению трех независимых
событий, следовательно:
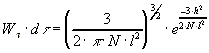
Для ансамбля, состоящего из n молекул, произведение
Wtdt
равно относительной доли молекул (dn/n), конец которых попадает
в элемент объема d при закреплении всех цепей в точке (0,0,0).
Вероятность того, что
имеет длину
,
не зависит от направления
и пропорциональна произведению Wt на элемент объема шарового
слоя
,
в котором находятся концы всех векторов длиной от h до h+dh
или:
То есть произведение Whdh равно относительному числу
молекул (dn/n), для которых длина вектора
заключена в интервале от
h до h+dh.
В соответствии с этим распределением принято различать следующие статистические характеристики свободного состояния цепи.
Среднее значение длины цепи h:
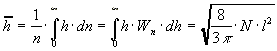
Наиболее вероятное значение длины свободно-сочлененной цепи:
.
Среднеквадратичное значение:
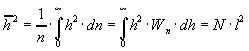
В полимерной цепи, где все валентные углы, соединяющие сегменты, фиксированы и одинаковы, а вокруг всех одинарных связей разрешено свободное вращение, для среднеквадратичного значения имеем следующее выражение:
.
Каждое макросостояние полимера характеризуется определенными значениями молекулярных параметров и может осуществляться большим количеством микросостояний (конформаций). Тепловое движение и вращение вокруг одинарных связей (пептидных) должно приводить к значительной свернутости цепи и образованию клубка.
,
где w - термодинамическая вероятност, kБ - константа Больцмана.
.
Cила, необходимая для растяжения полимерной цепи:
,
где U - внутренняя энергия. В первом приближении внутренняя энергия не зависит от конформаций, поэтому:
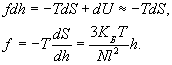
(сила линейно зависит от размеров)
В полимерных нитях, вследствие взаимосвязанности звеньев, изменение
плотности в одной точке пространства связано с изменением плотности в другой
точке, то есть существует пространственная корреляция плотности. Если в
макромолекуле отсутствует объёмное взаимодействие, то она не имеет достоверной
пространственной структуры. В этом состоянии флуктуация (изменение вероятности)
плотности имеет значение того же порядка, что и сама плотность. Такое состояние
носит название клубка. Радиус корреляции,
то есть характерное расстояние, в пределах которого плотность звеньев резко
меняется, становится того же порядка, что и размеры макромолекулы R:
(~R, R~
,
).
Наличие объёмных взаимодействий может привести к такому состоянию, в
котором флуктуация плотности мала по сравнению с самой плотностью. Такое
плотное образование называется глобулой. В нем радиус корреляции
флуктуации плотности намного меньше размеров молекулы <<R.
Глобула в отличие от клубка обладает компактной пространственной структурой.
Сердцевина большой глобулы примерно однородна, с постоянной концентрацией
звеньев n0.
(
- характерный размер без учета объёмного взаимодействия,
-
коэффициент набухания молекулы.
В области ,
>1
и
=1 при
=
t. В сильных растворителях притяжение электронов цепи и растворителя больше,
чем звеньев цепи, что равносильно повышению их взаимного отталкивания,
т.е.
>1.
При температурах t <
во взаимодействиях преобладают силы притяжения, которые могут привести
к конденсации клубка в плотную, слабо флуктуирующую глобулу. Эта глобула
стабилизируется самосогласованно со сжимающим полем, обусловленным силами
притяжения между мономерами. Примером перехода глобулы в клубок может служить
зависимость вязкости раствора полиглутаминовой кислоты от её кислотности.
В реальных макромолекулах объёмное взаимодействие в отсутствие внешнего воздействия создаёт самосогласованное поле, приводящее к образованию глобулы. Характер распределения плотности имеет другой вид:
Профиль плотности - размытые ступеньки, в сердцевине - постоянная концентрация звеньев n0. Для данного графика R~N1/3, - радиус корреляции.
При малых расстояниях преобладает сила отталкивания, и Fотталк >0, при больших r преобладает сила притяжения. Общую энергию можно представить в виде:
U(r)=Uотт(r)-Uпритяж(r).
Минимум на графике соответствует равновесию.
ВВ силы играют важнейшую роль в образовании конденсированных жидких
и твёрдых состояний. Ими определяются взаимодействия газов и возникающие
отклонения законов идеальных газов. Эти отклонения подчиняются уравнению
Ван-дер-Ваальса для газов:
,
где a, b - константы притяжения и отталкивания; V -объем.
Биомакромолекулы можно рассматривать как своего рода конденсируемые системы, состояния которых определяются относительно слабых невалентных взаимодействий. Именно такие взаимодействия дают основной вклад к стабилизации конденсации состояния биополимеров и его изменения в процессе функционирования. Значения энергии при ВВ взаимодействиях лежат в интервале 4-8 кДж/моль и выше. Энергия при комнатной (температуре) составляет 2,5 кДж/моль, а энергия коллективных ионных связей составляет 150 -600 кДж/моль.
Силы ВВ имеют электромагнитную природу и определяются взаимодействием электрических диполей молекул. В зависимости от того, обладает ли взаимодействие молекулы электрическим дипольным моментом, или последнее возникает вследствие поляризации оболочек, существуют различные типы сил ВВ.
- коэффициент ионизации раствора макромолекул,
I - ионная сила раствора
Найдем энергию их взаимодействия:
,
Энергия взаимодействия двух диполей является функцией квадратичных, а не линейных членов, следовательно:
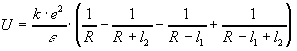
Разложим в ряд Тейлора:
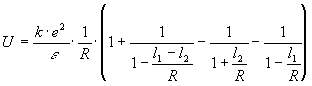
Имеем:
.
Если диполи свободны и совершают тепловое движение, то в среднем они будут принимать ориентации, соответствующие притяжению (так как в этом случае энергия их взаимодействия понижается). Вероятность взаимного расположения диполей зависит от их энергий, и в равновесии описывается законом Больцмана.
Расчет дает:
где телесный
угол.
.
В жидких и твердых телах поляризуемая молекула испытывает симметричное влияние большого количества соседних молекул, при этом результат их действия сильно компенсирует индукционное взаимодействие. Это приводит к тому, что реальное индукционное взаимодействие:
.
Энергия притяжения, обусловленная дисперсионными силами:
,
где
- частота колебаний (вращения) электрона; f - частотный фактор {сравним
с моментом инерции}.
ТАБЛИЦА. Относительная роль разных видов сил ВВ для отдельных молекул.
| Вещество | Р [D] | Uор | Uинд*105 Дж | Uдисп | |
|---|---|---|---|---|---|
| H | 0.67 | 0.00 | 0.00 | 0.00 | 6.10 |
| O2 | 1.51 | 0.00 | 0.00 | 0 | 39.80 |
| H2O | 1.48 | 1.84 | 190.00 | 10.00 | 47.00 |
| NH3 | 2.24 | 1.50 | 84.00 | 10.00 | 70.00 |
| HCl | 2.63 | 2.63 | 19.00 | 5.40 | 111.00 |
Суммарное ВВ взаимодействие есть Uориент+Uинд+Uдисперс, и для полимеров составляет от 4 до 100 кДж/моль. Силы ВВ лежат в основе некоторых биоструктур и, в частности, биспиральных полинуклеотидов. Упаковка плоских молекул азотистых оснований в вертикальной пачке обеспечивается вертикальными взаимодействиями (стекинг), в которых сила ВВ вносит основной вклад.
Для большинства полимеров энергия водородной связи
оценивается:
Uн=Uэл/стат+Uдисп+Uделок+Uотталк, =>
U=-25.2-12.6-33.6+35.3=-36.1 кДж/моль.
Как правило, для большинства биополимеров Uн связи лежит в пределах 1235 кДж/моль.
Потенциальная энергия водородной связи, соответствующая локализации протона около 2-х различных атомов азота.
Проявление водородной связи в спектрах, приводя к расширению инфракрасных полос поглощения А - Н групп, частоты колеблющихся групп, содержащих водородную связь, снижаются по отношению к их свободному состоянию.
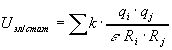
где ![]() -
проницаемость, для белков~3,5.
-
проницаемость, для белков~3,5.
Распределение зарядов частично заряженных атомов в трифосфате имеет вид:
Подобное точечное представление, полученное на основе квантовых расчетов, оправдано в тех случаях, когда размеры составляют 60-70% от суммы радиусов Ван-дер-Ваальса, т.е. характерных расстояний, которые определяются дисперсионными, ориентационными и индукционными взаимодействиями. cbpointloma ccharacter cddiscmaker center4creditcards cephus cgoeoe chadealer