Белки служат для запасания (примером является миоглобин) и переноса (гемоглобин) кислорода. Эта функция белков сходна с ферментативной, но отличается от нее тем, что молекулярный кислород не испытывает превращений в этих процессах. Специализированные белки высших организмов - гаммаглобулины - защищают организм от чужеродных биополимеров, выполняя тем самым иммунологическую функцию. Специальные (фибриллярные) белки входят в состав кожи, костей, волос, сухожилий и выполняют опорную функцию, обеспечивая не жесткую, но надежную взаимосвязь органов, а также их механическую целостность и защиту.
Реакция организма на большинство внешних воздействий любой природы сводится к перекодированию внешних сигналов на язык белковых взаимодействий.
Рассмотрим структуру пептидной связи.
Особенностью связи является то, что 4 атома N,H,C,O располагаются в одной плоскости (обведенная область на рисунке). Из химии известно, что вращение в молекуле вокруг ординарной связи приводит к появлению поворотных изомеров.
В белках вращение вокруг пептидной связи C-N затруднено (энергия активации 40 - 80 кДж/моль), т.к. эта связь имеет характер двойной связи и, кроме того, в пептидной группе имеет место водородная связь между группой С=O и атомом водорода группы N-H (с энергией активации 20-30 кДж/моль).
Поэтому белок можно рассматривать как цепь связанных друг с другом плоских
пептидных звеньев. Вращение этих звеньев возможно лишь вокруг одинарных
связей -углерода
и аминокислот (см. рис).
Угол поворота вокруг связи С-С обозначается , вокруг cвязи С-N обозначается .
Нахождение наиболее устойчивой конформации белковой цепи требует минимизации
ее полной энергии, включая энергию внутримолекулярных водородных связей.
Полинг и Кюри установили 2 основных варианта структуры белковой цепи, которые
называются -спираль
и
![]() -форма.
-форма.
|
|
|
 |
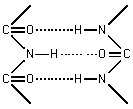 |
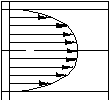
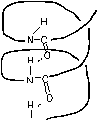
Рис.3.1. Ориентация водородных связей в структуре белка.
-спираль
может быть правозакрученной (
![]() =132о,
=132о, ![]() =123о)
и левозакрученной (
=123о)
и левозакрученной (![]() =228о,
=228о, ![]() =237о).
=237о).
![]() -формы бывают параллельные (
-формы бывают параллельные (![]() =61о,
=61о, ![]() =239о)
и антипараллельные (
=239о)
и антипараллельные (![]() =380о,
=380о, ![]() =325о).
=325о).
Кроме того, в белках встречаются участки, не образующие никакой регулярной структуры. Например, в гемоглобине 75% аминокислот образуют правозакрученные -спирали, а остальные участки цепи вообще никак не упорядочены. Упорядоченные участки часто называют кристаллической частью белковой молекулы, а неупорядоченные участки - аморфной формой белка.
Аморфные участки - депо строительного материала, который в случае необходимости используется для построения упорядоченных участков.
Рассмотрим свойства воды более подробно. Молекула воды является диполем из-за своей асимметрии. В водном растворе атом О2 располагается как бы в центре тетраэдра, в двух вершинах которого находятся атомы Н.
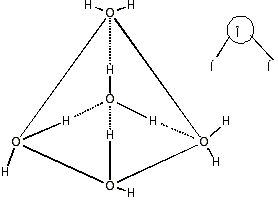
Рис. 3.2. Тетраэдрические свойства полностью координированной воды.
Две пары электронов кислорода, не участвующие в образовании валентной связи, находятся на вытянутых орбиталях, оси которых направлены к двум вершинам тетраэдра. Эти электронные пары несут отрицательный заряд и притягивают атомы водорода двух соседних молекул, то есть образуют водородные связи. Благодаря этим взаимодействиям в жидкой воде формируются ассоциации молекул, называемые кластерами. Структура кластеров сходна со структурой льда. Однако эта кристаллическая решетка отличается определенной "рыхлостью" ( именно этим объясняется невысокая плотность льда). Вместе с тем, даже после полного таяния льда в жидкой фазе воды сохраняются льдоподобные структуры - кластеры (расчеты показывают, что если бы их не было, то плотность жидкой воды была бы =1.8 г/мл, вместо 1.0 г/мл). Наличие в воде кластеров подтверждается данными рентгенографических исследований. Между неструктурированной водой и кластерами постоянно осуществляется обмен молекулами, так что в среднем время жизни кластера составляет 10-10 с. При 20 оС в воде доля несвязанных в кластеры молекул составляет 29.5%. С увеличением температуры средний размер кластера уменьшается, и доля несвязанных молекул возрастает (именно плавлением кластеров объясняется аномально высокая теплоемкость воды).
В воде хорошо растворяются такие органические соединения, которые содержат полярные группы и способны вступать в диполь-дипольное взаимодействие с молекулами воды или образовывать с ними водородные связи. Такими, в частности, являются группы:
Напротив, неполярные соединения плохо растворимы в воде. Физические причины этих явлений были выяснены после измерения термодинамических параметров процессов растворения. Было установлено, что в случае плохой растворимости углеводорода в воде изменение свободной энергии положительно, и, следовательно, энтропия системы уменьшается.
Что же означает уменьшение энтропии при растворении?
Прямыми физическими исследованиями было показано, что при этом происходит увеличение доли кластеров. При растворении молекулы углеводов втискиваются в полости внутри тетраэдрических ячеек кластеров и вытесняют оттуда неструктурированную воду. Последняя образует новые кластеры, и упорядоченность системы увеличивается, а значит, энтропия уменьшается. Поэтому гидрофобные взаимодействия являются результатом свойств воды, а не каких-то особых сил, связывающих неполярные группы друг с другом. Таким образом, ассоциация неполярных молекул в воде за счет гидрофобных взаимодействий определяется выталкивающим действием воды на неполярные соединения, что обусловлено тенденцией молекул воды к достижению состояния максимальной неупорядоченности.
-неполярные (гидрофобные)
-полярные (гидрофильные)
Степень гидрофобности остатка определяют по разности свободных энергий растворения аминокислоты в слабополярном растворителе и воде (обычно используют этиловый спирт).
Полученные таким образом величины разностей свободных энергий, приходящихся
на белковую группу аминокислоты при переносе из спирта в воду, приведены
в таблице:
| Гидрофобные |
|
|
|
|
|
|
|
|
|
|
|
|
| Гидрофобные |
|
|
|
|
|
|
|
|
|
|
|
|
| Гидрофильные |
|
|
|
|
|
|
|
|
|
|
|
|
| Гидрофильные |
|
|
|
|
|
|
|
|
|
|
|
Названия остатков: глицил, аланил, валил, лейцил, изолейцил (иле), фенилаланил (фен), пролил, тритофонил (три), серил (сер), треонил (тре), метионил (мет), аспарагинил (асп), глутаминил (глн), цистинил, аспаргил, глутамил (глу), тирозил, гистидил (гис), лизил (лиз), аргинил (арг).
Гипотеза об определяющей роли гидрофобных взаимодействий была доказана в 1944 году. Идея состояла в том, что гибкая молекула белка в воде сворачивается в глобулу (поскольку полярные остатки белка стремятся к максимальному контакту с водным окружением, а неполярные - к минимальному контакту). Из геометрии известно, что минимальной поверхностью при заданном объеме обладает шар. Стремление неполярных остатков образовать внутри белковой части некое подобие шарообразной капли, а полярных - сосредоточиться на ее поверхности, и приводит к образованию компактного тела - глобулы с гидрофобным ядром и гидрофильной поверхностью.
1 - гидрофобное ядро
2 - гидрофильная оболочка
В 1964 году Фишер установил, что, зная общее число аминокислотных остатков в ядре и отношение полярных остатков к неполярным, можно предсказать форму глобулы. Для простоты будем считать, что все остатки имеют одинаковые объемы. Найдем отношение числа полярных остатков к неполярным, которое обозначим bs. Будем считать , что радиус глобулы r0, и глобула покрыта мономолекулярным слоем полярных остатков толщиной d (Фишер считал, что d~4-5A). При сделанных допущениях отношение числа полярных и неполярных остатков равно отношению объемов сферического слоя и центрального ядра:
Следовательно, чем меньше r0, тем больше должна быть относительная гидрофильность белка. На рисунке приведена теоретическая кривая (кривая Фишера) значений параметра b от объема глобулы (V=4/3r03), а также экспериментальные значения.
Глобула может быть сферической, строго говоря, лишь при b=bs (соответствует кривой Фишера на графике). Если b>bs, то есть число полярных остатков в белке больше, чем необходимо для того, чтобы покрыть гидрофобное ядро гидрофильным слоем, то глобула вытягивается в виде эллипсоида и имеет большую поверхность, чем в случае сферы.
b>>bsвозникают фибриллярные структуры ( обозначено x на графике)
b<bsгидрофильные остатки не полностью закрывают гидрофобное ядро и гидрофобное взаимодействие между такими открытыми участками приводит к агрегации белков и возникновению надмолекулярных структур (обозначено на графике).
Таким образом, белки, для которых значения b лежат выше кривой Фишера, представляют собой эллипсоиды и фибриллы, значения лежат на кривой представляют собой глобулы. Под кривой располагаются белки, образующие надмолекулярную структуру. Формирование гидрофобного ядра в глобулярных белках имеет принципиальное значение для их функционирования. Белки при их огромной молекулярной массе обладают сравнительно компактной структурой прежде всего, благодаря гидрофобным взаимодействиям.
|
|
|
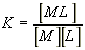 |
(2) |
Обозначим через r концентрацию связанного лиганда, через с
- концентрацию свободного лиганда в растворе, через N - концентрацию
центров связывания лигандов на макромолекуле. Тогда концентрация незанятых
лигандами центров связывания будет равна:
В этих обозначениях выражение для константы равновесия:
| (3) |
При заполнении половины центров связывания из уравнения получаем:
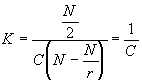 |
(4) |
Таким образом, k обратно пропорционально концентрации свободного лиганда в условиях 50% заполнения центров связывания.
На рисунке представлены данные по насыщению кислородом миоглобина и различных гемоглобинов человека. При построении графика удобно пользоваться не концентрацией О2, а его парциальным давлением (Y - степень связывания).
Кривые насыщения О2
1 - миоглобина
2 - фитального гемоглобина
3 - нормального гемоглобина
4 - гемоглобина, больного серповидной анемией
|
|
(5) |
Уравнение для кривой связывания можно получить, если решить уравнение (3) относительно r. Тогда получим уравнение (5). С увеличением концентрации лиганда доля занятых центров r стремиться к N. Из рисунка видно, что только связывание кислорода с миоглобином описывается гиперболой, а связывание с гемоглобином описывается S - образной зависимостью, которая обусловлена взаимодействием центров связывания между собой в процессе связывания.
В 1909 году Хиллом была предложена модель связывания кислорода с гемоглобином,
которая описывает экспериментальные данные. Согласно этой модели центры
связывания кислорода на молекулах гемоглобина не являются независимыми.
А именно присоединение одной молекулы кислорода к одному из центров увеличивает
сродство к кислороду других центров, а связывание двух молекул кислорода
ещё более облегчает связывание с третьей. Такое связывание, при котором
константы связывания идентичных центров изменяются по мере их заполнения,
называется кооперативным связыванием. Хилл рассмотрел модель максимальной
кооперативности, т.е. случай, когда связывание одного лиганда настолько
увеличивает сродство остальных центров, что они заполняются почти мгновенно.
Это значит, что в равновесном растворе лиганда N и макромолекулы, имеющих
n идентичных центров связывания, присутствуют либо макромолекулы с незанятыми
центрами связывания, либо комплексы лиганда с макромолекулой, у которых
все центры связывания заполнены. Таким образом, модель максимальной кооперативности
практически означает протекание такого кинетического процесса:
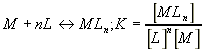 |
(6) |
В последнем выражении [M], [Ln], [N] - концентрации комплексов, свободного лиганда и свободных центров связывания. Степень насыщения центров связывания Y определяется как отношение концентрации связанных макромолекул к общей концентрации макромолекул в растворе.
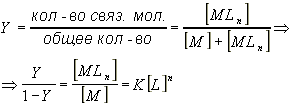
Хотя это уравнение выведено для случая полной кооперативности, графиком Хилла пользуются и для анализа процессов, кооперативность которых не является полной. В этом случае кооперативность характеризуется коэффициентом Хилла h, который равен максимальному тангенсу наклона.
График Хилла для насыщенного гемоглобином кислорода:
Связывание кислорода с гемоглобином, имеющим 4 центра связи, характеризуется параметром Хилла h=2,9. Уравнение хорошо описывает связывание от 10 до 80% насыщения углеродом (прямолинейный участок на последнем графике). По коэффициенту Хилла судят о степени кооперативности процесса. Если h=1, то кооперативность отсутствует (как у миоглобина), если h< 1, то говорят об отрицательной кооперативности, т.е. происходит уменьшение степени сродства по мере заполнения центра. Кооперативное связывание лигандов является лишь одним из примеров кооперативных процессов в биофизике. К их числу относятся такие процессы как плавление ДНК, обратимая денатурация белков, фазовые переходы в мембране клеток и многие другие.
Отметим физические процессы, приводящие к высокой степени кооперативности связывания кислорода с гемоглобином. Свободный и связанный гемоглобин отличается характером заселённости электронных орбиталей комплекса Гем (комплекс Гем является кофактором, в центре которого 2-хвалентное железо).
Уменьшение спина приводит к уменьшению ионного радиуса, и его структура становится более компактной. В результате происходит более плотная упаковка макромолекулы Нb(O2)4, в процессе которой затрачивается длинный фрагмент макромолекулы оксигенированного гемоглобина. Механизм оксигенации гемоглобина является примером электронно-конформационных взаимодействий (ЭКВ), характерных для большинства биополимеров. Суть концепции ЭКВ состоит в том, что в макромолекулах осуществляется сопряжение электронных процессов с конформационными (структурная перестройка).
Среднее время жизни эритроцита 8-120 суток. У здорового человека в одном миллилитре ~ 4-5 миллионов эритроцитов.
Типы гемолиза: осмотический; сдвиговый; поверхностный; механический
Краткая аннотация к перечисленным типам гемолиза.